Malattie genetiche Labrador: l’importanza dei test genetici sul DNA
In questo interessante articolo parliamo delle malattie genetiche, a oggi conosciute, per il Labrador Retriever.
La biologia molecolare è una risorsa fondamentale, sia per i proprietari dei cani che per gli allevatori che selezionano una determinata razza per escludere dalla riproduzione eventuali soggetti affetti da malattie genetiche.
Conoscere le caratteristiche genetiche dei propri cani permette di allevare soggetti privi di malattie genetiche e permette anche di conservare il patrimonio genotipico specifico di ciascuna razza.
Nessun allevatore e nessun privato amante di una razza dovrebbe sottrarsi dalla responsabilità di conoscere e di eseguire tutti i controlli sulle patologie genetiche.
Il test sul DNA attraverso tampone buccale o prelievo sangue (ETDA) serve per escludere dal programma di selezione in allevamento soggetti affetti dalle malattie genetiche e per evidenziare soggetti clinicamente sani anche se portatori del gene mutato (carrier).
Per quanto riguarda il Labrador Retriever, sono disponibili presso alcuni laboratori come Laboklin una serie di esami sul DNA che permettono di testare se il cane è:
- omozigote nei confronti del gene sano (Clear)
- portatore eterozigote della mutazione (Carrier)
-
omozigote nei confronti della mutazione (Affected)
Patologie genetiche ereditare nel Labrador
Vediamo quali sono le più importanti malattie genetiche nel Labrador per cui chiunque si appresta a fare nascere dei cuccioli (allevatore o privato) dovrebbe testare prima di accoppiare alla cieca.
- DM / Mielopatia degenerativa (gene SOD1)
- EIC / Collasso indotto da sforzo (gene DNM1)
- HNPK / Paracheratosi nasale ereditaria (geneSUV39H2)
- prcd-PRA / Atrofia progressiva della retina (gene PRCD)
- OSD / Displasia retinica
- CNM / Miopatia ereditaria (gene PTPLA)
- SD2 / Nanismo-Skeletal Dysplasia 2 (gene COL11A2)
- Cistinuria (gene SLC3A1)
- PK / Deficit di piruvato chinasi (gene PK-LR)
- SLC-HUU / Iperuricosuria (gene SLC2A9)
- Malattia di Alexander (gene GFAP)
- STGD-PRA / Malattia di Stargardt (gene ABCA4)
- XL-MTM / Miopatia legata al cromosoma X (gene MTM1)
- NARC / Narcolessia (gene hcrtr2)
- Obesità (gene POMC)
Mielopatia degenerativa (DM)
La mielopatia degenerativa è una malattia genetica autosomica recessiva che provoca dolore. La sua degenerazione è progressiva e colpisce il midollo spinale nei cani anziani. La malattia ha un’insorgenza insidiosa, tipicamente tra gli 8 e i 14 anni di età.
Inizia con una perdita di coordinazione (atassia) negli arti posteriori. Il cane affetto vacilla quando cammina o trascina le zampe.
Questo può verificarsi prima su di un arto posteriore e poi influenzare l’altro. Con il progredire della malattia, gli arti diventano deboli e il cane inizia a stare spesso steso perché ha difficoltà a stare in piedi.
La debolezza peggiora progressivamente fino a quando il cane non è in grado di camminare. Il decorso clinico può variare da 6 mesi a 1 anno prima che il cane diventi paraplegico.
Se i segni progrediscono per un periodo di tempo più lungo, può verificarsi una perdita di continenza urinaria e fecale e, infine, si svilupperà una debolezza negli arti anteriori.
Risultati DM: N/N (Clear = sano), DM/N (Carrier = portatore), DM/DM (Affected = affetto)
Collasso indotto da sforzo (EIC)
Il collasso indotto da esercizio fisico (EIC) è una malattia genetica autosomica recessiva che causa nei cani colpiti una perdita di controllo muscolare dopo periodi di esercizio fisico estremo.
In genere, un cane affetto (omozigote per EIC) inizia a mostrare sintomi tra i 5 mesi e i 3 anni di età, di solito intorno all’età in cui inizia l’addestramento più intenso.
Gli episodi di EIC si verificano generalmente dopo 5-25 minuti di esercizio fisico estremo. Non tutti i tipi di esercizio fisico possono indurre un attacco: generalmente il cane deve essere in corsa ed eccitato per un lungo periodo di tempo.
Gli attacchi spesso iniziano con il dondolio, seguiti dalla debolezza degli arti posteriori che diventano deboli e cedono.
La gravità di questi attacchi varia da un soggetto all’altro; alcuni continueranno a cercare di recuperare, trascinando le zampe posteriori, mentre altri saranno totalmente incapaci di muoversi, agendo in modo disorientato.
Questi attacchi durano solitamente solo 5-25 minuti circa, ma, in alcuni casi estremi, i cani sono morti immediatamente dopo un attacco EIC.
Un soggetto affetto (EIC/EIC) può essere accoppiato solo con un clear (N/N): in questo modo la prole non sarà mai colpita da questa malattia.
Risultati EIC: N/N (Clear=sano), EIC/N (Carrier=portatore), EIC/EIC (Affected=affetto)
Paracheratosi nasale ereditaria (HNPK)
La paracheratosi nasale ereditaria (HNPK) è un disturbo autosomico recessivo ereditato nei Labrador Retriever. Una mutazione dei nucleotidi T>G nel gene SUV39H2 provoca l’essiccamento del naso, con conseguente irritazione cronica e infiammazione della pelle del naso.
I sintomi del disturbo compaiono generalmente intorno ai 6-12 mesi di età. I cani colpiti sviluppano croste secche, ruvide, grigie o marroni sulla superficie e sul bordo del naso. In alcuni casi, le crepe che sono dolorose compaiono intorno e sulla punta del naso.
Se non trattati, i soggetti colpiti possono sviluppare infezioni batteriche superficiali. Nel corso del tempo, il naso spesso inizia a depigmentizzare, cambiando il colore della pelle da scuro a chiaro.
Anche se il disturbo non è potenzialmente letale, è necessaria una cura continua per ridurre il ripetersi di un’eccessiva crosta nasale per tutta la vita del cane.
Poiché l’HNPK è un disturbo recessivo, un cane deve avere due copie della mutazione affinché la malattia si manifesti, ovvero deve essere affetto (HNPK/HNPK)
Questo significa che un soggetto con una sola copia della mutazione non svilupperò mai la malattia in quanto solo portatore.
Il portatore può trasmettere il gene normale o il gene mutato a qualsiasi discendenza. Se vengono allevati due soggetti portatori, c’è una probabilità del 25% di avere un cucciolo che riceve due copie mutate del gene e sarebbe affetto da HNPK.
Risultati HNPK: N/N (Clear=sano), HNPK/N (Carrier=portatore), HNPK/HNPK (Affected=affetto)
Atrofia retinica progressiva (prcd-PRA)
L’atrofia retinica progressiva (prcd-PRA = pro-rod-cono-degeneration) come malattia genetica ereditaria si verifica in molte razze canine (non solo nel Labrador) e anche in forme diverse.
La degenerazione progressiva delle cellule che costituiscono la retina (ROD – CONO) avviene in cani di solito entro 5 anni di età con insorgenza variabile.
Questo disturbo genetico causa la degenerazione delle cellule della retina nell’occhio: in primo luogo, le cellule ROD sono colpite, quelle destinate alla visione nottura, portando così ad una progressiva cecità in mancanza di luce. Successivamente la degenerazione si sposta sulle cellule CONO che causa la completa cecità del cane anche in situazioni di piena luce durante il giorno.
L’età di insorgenza dei sintomi clinici avviene tipicamente nella prima parte dell’adolescenza o nella prima età adulta. Tuttavia, l’insorgenza della malattia può variare tra le diverse razze di cani.
Poiché la diagnosi delle malattie a carico della retina può rivelarsi difficile, il test genetico su prcd-PRA aiuta a diagnosticare una specifica malattia ed è anche uno strumento a chi alleva seriamente per eliminare il gene mutato dalla selezione in allevamento.
Miopatia centronucleare (CNM)
La miopatia centronucleare (CNM) è una miopatia ereditaria del Labrador Retriever derivante da una mutazione della proteina tirosina fosfatasi (PTPLA), difficile da diagnosticare clinicamente dalle altre miopatie congenite ereditarie nel labrador.
Questa condizione è anche conosciuta come:
- deficit di fibre muscolari di tipo II
- distrofia muscolare autosomica recessiva
- miopatia ereditaria
La malattia viene ereditata in modo autosomico recessivo ed entrambi i sessi ne sono colpiti in egual misura. La miopatia ereditaria si manifesta tipicamente nei cuccioli a 2-5 mesi.
I sintomi di CNM includono: perdita generalizzata di tono e controllo muscolare, intolleranza all’esercizio fisico e andatura scomoda.
I soggetti con una copia normale (Clear) e una copia mutante del gene (Carrier) non mostrano segni ma non mostreranno mai la malattia. Diversamente invece, se si accoppiano due portatori eterozigoti della mutazione questi daranno cuccioli per il 25% sani, 50% portatori e 25% affetti.
Anche per questa patologia genetica, gli allevatori possono utilizzare i risultati del test come strumento di selezione nella riproduzione per evitare di fare nascere cuccioli affetti.
Risultati CNM: N/N (Clear=sano), CNM/N (Carrier=portatore), CNM/CNM (Affected=affetto)
Osteocondrodisplasia (SD2 Skeletal Dysplasia 2)
La displasia scheletrica (nanismo) è una malattia genetica del Labrador Retriever che causa un arresto precoce nella crescita delle articolazioni. È generalmente caratterizzata da una o più parti del corpo più piccole rispetto alle dimensioni complessive dell’animale.
A differenza di altre forme di nanismo (nanismo ipofisario), il risultato è un cane “sproporzionato” con arti anteriori accorciati e linea dorsale anomala. Spesso le zampe anteriori sono più colpite rispetto a quelle posteriori. Questo causa una posizione e un’andatura “scomoda”.
La lunghezza e la profondità del tronco non vengono alterate. In base alle conoscenze più recenti, i cani che hanno ereditato il gene mutato (affetti) non presentano ulteriori sintomi come genitali malformati o malattie neuronali come nel nanismo ipofisario.
Alcuni studi affermano che le linee di lavoro più sottili hanno maggiori probabilità di ereditare la variante SD2. Nella maggior parte dei casi i maschi colpiti avevano un’altezza della spalla inferiore a 55 cm e le femmine colpite avevano un’altezza della spalla inferiore a 50 cm. Lo standard internazionale di razza è di 56-57 cm per i maschi e 54-56 cm per le femmine.
Risultati SD2: N/N (Clear=sano), SD2/N (Carrier=portatore), SD2/SD2 (Affected=affetto)
Cistinuria (CY)
La cistinuria è una malattia autosomica recessiva ereditaria causata da un trasporto difettoso dell’aminoacido cistina nei tubuli renali che colpisce oltre 70 razze tra cui anche il Labrador Retriever.
Normalmente, la cistina viene filtrata nel rene e riassorbita all’interno dei tubuli, determinando poca cistina nelle urine. I Labrador con cistinuria non riassorbono adeguatamente la cistina (e pochi altri aminoacidi) nei tubuli renali, causando la presenza di livelli anormalmente elevati di cistina nell’urina.
La cistina è insolubile a pH neutro o nelle urine acide, quindi un eccesso di cistina urinaria provoca la formazione di cristalli, che a loro volta possono portare alla formazione di calcoli di cistina (calcoli) nel rene e/o nella vescica.
I Labrador che soffrono di Cistinuria soffrono di ripetute infiammazioni delle vie urinarie e sono a rischio di blocco urinario che, se non trattato tempestivamente, può portare a insufficienza renale, rottura della vescica e morte.
Nuovi studi hanno dimostrato che questa malattia è molto eterogenea in termini di ereditarietà, mutazione, frequenza, gravità, trattamento e sintomi.
La designazione di Cistinuria di tipo I viene utilizzata quando la malattia mostra un’eredità autosomica recessiva, di tipo II quando l’ereditarietà è autosomica dominante e di tipo III per l’eredità limitata dal sesso/dipendente dagli androgeni (PH, UG).
Mutazioni specifiche all’interno di ciascun tipo dovrebbero portare a fenotipi sufficientemente simili da applicare la stessa gestione medica e consigli sull’allevamento a tutti i casi all’interno di quel tipo. Il coinvolgimento del gene SLC3A1 è indicato aggiungendo -A, e allo stesso modo l’addendum di -B indicava il coinvolgimento delle mutazioni in SLC7A9.
- Labrador: Tipo I -A – eredità autosomica recessiva
Risultati CY: N/N (Clear=sano), CY/N (Carrier=portatore), CY/CY (Affected=affetto)
Deficit di piruvato chinasi (PK)
Il deficit di piruvato chinasi è una malattia metabolica ereditaria che colpisce i Labrador Retriever. I soggetti affetti hanno un’attività insufficiente dell’enzima piruvato chinasi che scompone il glicogeno per produrre energia.
La carenza di questo enzima si traduce principalmente in globuli rossi facilmente danneggiati (emolisi). I cani affetti presentano tipicamente tra i 4 mesi e i 2 anni di età con gengive pallide dovute alla diminuzione del numero di globuli rossi (anemia) e letargia o intolleranza all’esercizio.
I risultati clinici durante un esame veterinario includono grave anemia, indurimento delle ossa e milza e fegato ingrossati. Sebbene i cani possano vivere per diversi anni con questa malattia, in genere muoiono di grave anemia o insufficienza epatica entro i 5 anni di età.
Il test genetico del gene PK determinerà in modo affidabile se un cane è un portatore genetico di carenza di piruvato chinasi. Il deficit di piruvato chinasi è ereditato in maniera autosomica recessiva, il che significa che i cuccioli devono ricevere due copie del gene mutato (una da ciascun genitore) per sviluppare la malattia.
I soggetti portatori non hanno segni della malattia ma se accoppiati con un altro portatore della stessa mutazione, c’è il rischio di avere cuccioli affetti.
Ogni cucciolo che nasce da questo accoppiamento ha una probabilità del 25% di ereditare la malattia e una probabilità del 50% di essere portatore della mutazione del gene PK.
Quindi i test genetici sono affidabili e importanti per determinare le scelte di accoppiamento, al fine di eliminare questa mutazione dalle proprie linee riproduttive ed evitare la possibilità di far nascere cuccioli affetti (è sconsigliato l’accoppiamento tra due portatori).
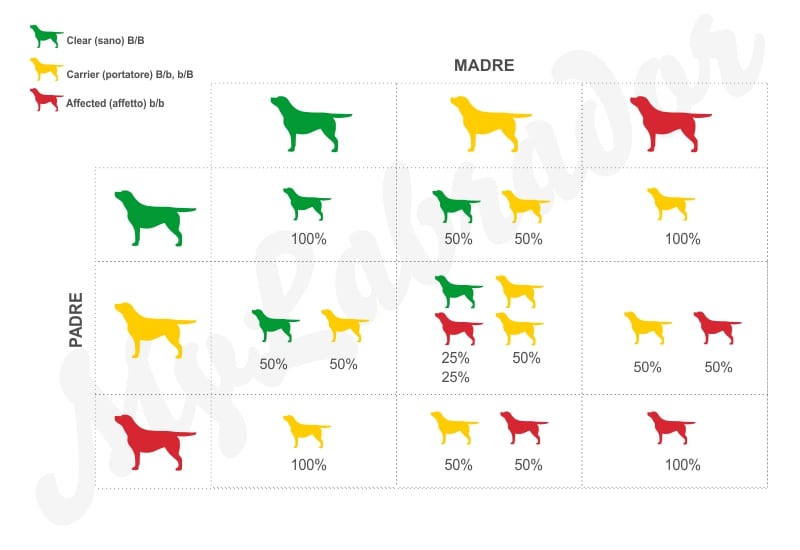
Le combinazioni tra Clear, Carrier e Affected
Queste malattie sono completamente genetiche dove il fattore ereditario è del 100% e sono completamente riconducibili ai genitori: questo significa che non possono esserci altre variabili di passaggio sui cuccioli.
Ben diverso invece è il discorso quando si parla della displasia coxo-femorale dell’anca e del gomito che solo in piccola parte può risultare geneticamente influenzabile (25%) e definita per questo motivo “multifattoriale“.
Tutte le malattie completamente genetiche si presentano come ereditarietà autosomica recessiva, ovvero è necessario che entrambi i genitori siano portatori del gene malato, per trasmettere la malattia alla prole.
Un soggetto Carrier non sarà mai colpito dalla malattia nei suoi caratteri visibili, ma se questo cane si accoppiasse con un altro soggetto portatore, allora trasmetterebbe a sua volta la malattia alla prole (25% sani, 25% portatori, 50% affetti).
L’importanza dei test genetici per escludere soggetti affetti dalla riproduzione
Risulta chiaro che si può utilizzare in riproduzione un soggetto clinicamente sano ma portatore del gene, qualora lo si faccia accoppiare con un soggetto sano, non portatore.
Un allevatore può utilizzare per la selezione della razza un soggetto portatore (Carrier) a patto che l’altro soggetto sia sano (Clear).
Se si accoppia una femmina testata prcd-PRA risultante Carrier (portatore) con un altro labrador che è portatore o addirittura affetto da questa patologia, allora il 50% dei cuccioli sarebbero colpiti da cecità e il 50% saranno portatori sani non sviluppando mai la malattia.
Quando acquistate un cucciolo richiedere sempre il test sui genitori
Un esemplare testato Carrier per una determinata malattia genetica, non deve essere escluso a priori dalla selezione, ma occorre verificare le condizioni genetiche dell’altro soggetto, al fine di non scegliere un altro Carrier ma sempre un Clear.
L’importante infatti è che uno almeno uno dei genitori sia Clear, per non trasmettere la malattia genetica al cucciolo.
Purtroppo non tutti gli allevatori sottopongono i propri cani a questi esami, figuratevi il privato che fa cucciolate, e questo non permette di avere un quadro genetico chiaro, accettando anche di dover escludere dalla selezione un soggetto.
Di contro invece, proprio i risultati dei test DNA permettono di favorire una migliore selezione e limitare gli azzardi, al fine di preservare la salute stessa della razza.
Tutti i nostri labrador hanno test sul DNA Laboklin o Genefast.